Библиотека
Невидимый орган человека
Г.А. Осипов
доктор биологических наук, ведущий научный сотрудник Академической группы Академика РАМН Ю.Ф. Исакова при Научном центре сердечно-сосудистой хирургии им. А.Н.Бакулева
На рубеже ХХI века сформировалось представление о микрофлоре организма человека как о еще одном органе, покрывающим в виде чулка кишечную стенку, другие слизистые оболочки и кожу человека.
Оставаясь невидимым, этот «орган» весит около двух килограммов и насчитывает порядка 1014 клеток (сто биллионов) клеток микроорганизмов. Это число в десять раз превышает число собственных клеток организма-хозяина, то есть — человеческих.
К представлению о единстве сообщества микроорганизмов, обитающих в нашем теле, привели первоначально исследования экологических и биотехнологических микробных сообществ.
Оказалось, что микробы, во-первых, предпочитают жить, будучи прикрепленными к твердой поверхности, нежели свободно плавающими – как в водной среде рек и океана, в воздухе.
Во-вторых, они организованы в так называемые биопленки, сбалансированные по видовому составу и функциональному распределению членов сообщества – как муравьи в муравейнике. В биотехнологии стремятся специально подобрать оптимальное сообщество микроорганизмов для выполнения определенных функций. Это актуально в производстве пищевых продуктов, лекарств и пищевых добавок, утилизации разного рода отходов, нейтрализации загрязнений воды и почвы нефтепродуктами.
Такие сообщества называют консорциумами микроорганизмов. Практика показала многократное увеличение эффективности работы микроорганизмов при такой организации. Консорциум, вообще-то, понятие биотехнологическое и предполагает сообщество микроорганизмов, специально созданное для осуществления определенной цели.
В нем (сообществе) определены количественые и функциональные отношения. Они должны быть строго постоянны, иначе цель не достигается. В биотехнологии — это срыв производственного процесса (скажем, кефира или пива). У человека такого допустить нельзя, его биореактор (кишечник) должен работать всю жизнь.
Поэтому природа постаралась так организовать микробное сообщество, что оно сохраняется в течение всей жизни при максимальном колебании в концентрации отдельных микробов. Независимо от применения антибиотиков. Правильное их применение наряду с восстановительными мерами приводит к сохранению микрофлоры в прежних рамках.
По данным молекулярно-генетических исследований состав микрофлоры генетически связан внутри сообщества и специфичен на штаммовом уровне для индивидуума. Это очень прочная система. Туда нельзя внедрить чужеродный штамм. Нетрудно оценить ее гораздо большую антибиотикорезистентность in-vivo по сравнению с опытами в чашке Петри. Достаточно капли антибиотика в чашке, чтобы воспрепятствовать росту микроорганизмов в радиусе 42 мм (высокая чувствительность). В то же время кишечник остается заселенным при длительном применении антибиотиков широкого спектра действия.
Способ существования микроорганизмов в кишечной биопленке
На сегодня нет точного описания архитектуры микробного сообщества пристеночного слоя кишечника. Попытаемся предложить модель биопленки на основе известных фактов. Микроорганизмы, в количестве 1011 клеток/см3 должны быть распределены в пристеночном слое муцина – относительно прочного геля, состоящего из пептидогликана, продуцируемого бокаловидными клетками эпителия кишечной слизистой оболочки.
Сразу следует заметить, что он близок по химической природе полисахаридной защитной капсуле, которой окружают себя многие микробы. Т.е. в муцине они должны себя «чувствовать» как рыба в воде. Такая среда выглядит пригодной для существования микроорганизмов в тонких слоях муциновой слизи в виде равномерно распределенных клеток на достаточно близком расстоянии (порядка размера микробной клетки) друг от друга.
Такое расположение должно обеспечивать контакт с диффундирующим в муцин химусом и клетками между собой для быстрого обмена продуктами метаболизма. Оно должно отвечать представлению о биопленке, как о псевдоцитологической структуре (Фото 1.)
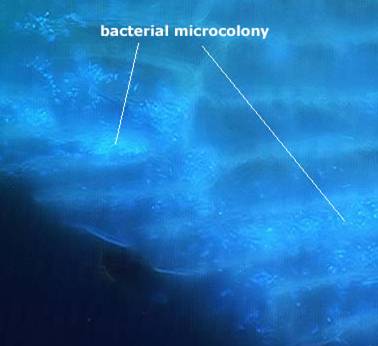
Фото 1. Скопления бактерий, колонизирующих муцин толстого кишечника
(заимствовано с сайта University of Dundee, Scottland)
В достаточно толстом слое муцинового геля можно предполагать и видеть другие формы микробной биопленки – в виде слоя, прикрепленного к клеткам эпителия, или отдельно расположенных конгломератов клеток (фото 2).
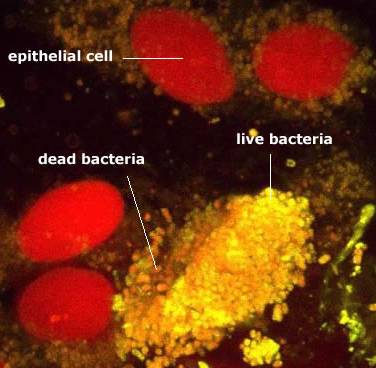
Фото 2. Микроколонии бактерий в биоптате прямой кишки расположены вокруг
эпителиальных клеток или в виде отдельных агрегатов
(заимствовано с сайта University of Dundee, Scottland)
Достойна удивления способность микробиоты кишечника сохранять стабильность в условиях разнородных химических и корпускулярных потоков, пронизывающих муцин вдоль и поперек. В соответствии с физиологическими канонами через кишечную стенку и вдоль нее ежесуточно проходит десять литров жидкости, включая слюну, желудочный сок с пищевым химусом, желчные и печеночные секреты и прочее.
В противоположном всасыванию направлении движется муцин, который микробы кишечной стенки должны успевать переваривать на мономерные составляющие со скоростью его образования клетками слизистой оболочки.
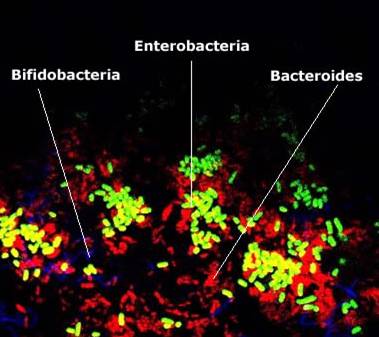
Фото 3. Выявление кишечных бактерий отдельных родов в искусственной среде, моделирующей кишечную микробиоту. Применен метод FISH (Fluorescent In Situ Hybridization) – гибридизация тестовой ДНК непосредственно в пробе с окрашиванием различными флюоресцентными метками
(заимствовано с сайта University of Dundee, Scottland)
Специальные исследования показали, что в биопленке по иному, в сравнении с чистыми культурами бактерий, происходят их многочисленные физиологические процессы, в том числе продукция метаболитов и биологически активных веществ. Сообщество организует единую генетическую систему в виде плазмид – кольцевых ДНК, несущих поведенческий код для членов биопленки, определяющих их пищевые (трфические), энергетические и другие связи между собой и внешним миром.
Последнее получило специальное определение как социальное поведение (quorum sensing) микроорганизмов. Реакция микроорганизмов на изменение условий окружающей среды в биопленке существенно отличается от реакции каждого отдельного вида в монокультуре.
Такая организация обеспечивает ее физиологическую и функциональную стабильность и, следовательно, является залогом конкурентного выживания в экологической нише. В организме человека специфическое преимущество такой организации заключается в обеспечении гомеостаза органов, функциональность которых зависит от населяющих их микробов.
Здоровый вид кожи, нормальное пищеварение, устойчивость к внешней инфекции (состояние иммунитета) человека во многом определяется стабильностью, можно сказать, «здоровьем» его микрофлоры.
Преимущество коллективного реагирования имеет и отрицательную сторону: таким сообществом трудно управлять извне. Например – лечить заболевания полимикробного происхождения, когда чувствительность к антибиотикам микроорганизмов, ассоциированных в биопленку, не соответствует таковой, определенной в лабораторных тестах на клинических изолятах чистых культур бактерий.
Коллективный иммунитет биопленки практически сводит на нет хорошую идею коррекцию дисбактериозов с помощью пробиотиков – препаратов живых культур ключевых микроорганизмов кишечника – бифидобактерий, лактобацилл, энтеробактерий и других.
Несомненно, они создают эффект, но не всегда и не такой, как предполагалось по идее. Это происходит из-за коллективного иммунитета микробиоты (организованной микрофлоры) кишечника. Микробы, выращенные искусственно, являются инородными, как инородны пересаживаемые человеку органы и ткани других людей – доноров, или животных. Они отторгаются вследствие биологической несовместимости.
Биотехнологические пробиотики не имеют «пароля» для входа микробов внутрь биопленки кишечника, и поэтому пребывают в нем транзиторно, как микрофлора пищи. Это признают фирмы – производители пробиотиков и не утверждают, что их добавки восполняют физически дефицит соответствующих содержимому пробиотика микроорганизмов, но стимулируют рост ущемленной популяции.
Отсутствие приживаемости чужеродных микробов подобного вида есть косвенное доказательство существования микрофлоры человека как самостоятельного органа. Появился термин «парацитология биопленки», как структуры, похожей на ткань высших организмов что подразумевает выполнение в ней законов, ей присущих.
Существует еще множество обстоятельств, в силу которых микробиоту человека следует рассматривать как индивидуально специфичную, генетически детерминированную и, видимо, – наследуемую. Они подробно рассмотрены в трехтомнике проф. Б.А.Шендерова «Медицинская микробная экология и рациональное питание».
На основании такого вывода Б.А.Шендеровым предложена (в виде авторского свидетельства, полученного в начале девяностых годов прошлого века) идея консервации индивидуальной микрофлоры в молодом здоровом периоде жизни конкретного человека с целью допирования ее в будущем при серьезных нарушениях кишечного биоза с целью его оздоровления, даже можно сказать — омоложения. Гастроэнтерологам же известны случаи «пересадки» микрофлоры больному от родственника «пер клизмум» с положительным эффектом коррекции дисбактериоза кишечника.
Современные представления о составе микробиоты кишечника по данным молекулярных исследований
Сведения о природе микробиоценоза кишечника, накопленные к настоящему времени, выглядят достаточными для понимания его функционирования, как физиологически активного органа человека. Однако для их реализации в управлении этим органом при патологиях, причинно-следственным образом связанных с дисбактериозом, недостает количественного метода определения изменений в составе достаточно широкого круга ключевых микроорганизмов и их мониторинга в процессе коррекции.
Причем желательно анализировать состав пристеночной кишечной микробиоты, а не микрофлоры фекалий, как это принято повсеместно. Именно в мукозном слое, облегающем слизистую оболочку кишечника происходит усвоение пищевого химуса, поступающего из желудка, усвоение необходимых питательных веществ клетками эпителия кишечной стенки и дополнительная продукция микроорганизмами большого числа биологически активных веществ: ферментов, витаминов, антибиотиков, иммуностимуляторов, а также токсинов и метаболитов, вредных для человека.
Предполагается, что отсутствие баланса в их продукции связано с патологическими проявлениями самого разного характера: кишечные расстройства, кожные заболевания, половые дисфункции и сердечная недостаточность. Микрофлора фекалий является отходом этих процессов, в котором продолжается продукция микроорганизмов, но уже в иных условиях по сравнению с верхними отделами кишечника.
По мнению известного специалиста в области клинической микробиологии проф. А.Н.Маянского она отражает скорее полостную (свободноживущую, или планктонную), чем пристеночную биопленку, которая более стабильна и физиологична. Цитируя Маянского в части определения дисбактериоза кишечника по фекалиям нельзя не согласиться, что «Фактически это дорогостоящее (тем более, что тестирование рекомендуется делать в динамике), трудоемкое исследование с невысокой (если не с нулевой) отдачей».
Подходящий для решения такой задачи метод появился в России в начале 90-х прошлого уже века. Он был разработан на базе исследований НИИ биологического приборостроения при поддержке академика РАН Г.А.Заварзина и гранта Министерства экологии и охраны недр РФ «Экологическая безопасность России».
Метод основан на выявлении присутствия микроорганизмов в объектах окружающей среды (воде, почве, стоках и т.п.) по специфическим для них химическим веществам – маркерам из числа жирных кислот, альдегидов и стеринов, входящих в состав их клеточной стенки. Специфичность означает, что подобные вещества содержатся только в липидах микроорганизмов и не содержатся в среде их обитания.
Поэтому, имея достаточно чувствительный метод анализа их можно обнаружить и измерить количественно непосредственно в среде обитания, избежав необходимости предварительно культивировать их на искусственных средах. Это оказалось возможным сделать с помощью метода газовой хроматографии в сочетании с масс-спектрометрией (сокращенно – ГХ-МС).
Существо анализа состоит в прямом извлечении с помощью химической процедуры высших жирных кислот из образца, подлежащего исследованию (почвы, ила, клинического материала), их разделения на хроматографе в капиллярной колонке высокого разрешения и анализа состава в динамическом режиме на масс-спектрометре.
Поскольку хроматограф соединен в едином приборе с масс-спектрометром и снабжен компьютером с соответствующими программами автоматического анализа и обработки данных, сам процесс анализа занимает 40 мин. Его результатом является определение состава микробных маркеров с точностью 2% относительных. Вместе с пробоподготовкой и расчетом состава микробного сообщества по отдельной программе стандартная процедура контроля 170 микроорганизмов в пробе занимает около 5 часов.
Метод детектирования микроорганизмов по ЖК-маркерам сродни генетическому (ПЦР, определение последовательности нуклеотидов 16sРНК и пр.), поскольку состав жирных кислот детерминирован в ДНК и воспроизводится путем репликации участка генома транспортными РНК и последующего синтеза ЖК в митохондриях по матричным РНК.
Поэтому профиль ЖК бактерий является их визитной карточкой или фингерпринтом как отпечатки пальцев людей (Митрука, 1978). Он так же консервативен, как строение ДНК, но и так же подвержен мутациям под действием факторов окружающей среды.
Стабильность набора жирных кислот, составляющих клетки микробов, подтверждается исследованиями в области бактериальной палеонтологии, которые показывают, что до глубины времен в 2,5 млрд лет состав ЖК отдельных микробов и пула их жирных кислот в целом остается постоянным (Шеховцова, 2002).
Бактерии, законсервированные в донных отложениях древних озер Антарктиды (возраст 1,5 миллиона лет), удается оживить в лабораторных исследованиях и показать их идентичность современным видам по молекулярным признакам – составу жирных кислот клеточных стенок (Воробьева, 2002).
По этому принципу построена хемодифференциация микроорганизмов, которая широко используется как метод их идентификации и подтверждения таксономического положения (Minnikin, 1985). Он применяется для работы с монокультурами микроорганизмов и основан на использовании очень больших баз данных, содержащих сведения о составе жирных кислот нескольких тысяч штаммов бактерий и микроскопических грибов.
Примером такой системы является специализированный хроматограф Microbial Identification System, выпускаемый фирмой MIDI Inc., Делавер, США [Stead, 1992]. Особенности состава жирных кислот теперь используют наряду с другими параметрами в бактериальной таксономии и клинической бактериальной диагностике [Вейант, 1999 ].
Методология анализа микробных сообществ методом ГХ-МС была опубликована как в отчете по теме гранта Минэклогии РФ «Экологическая безопасность России», так и в последовавшем описании патента на способ анализа. Она распространена при поддержке академиков РАМН Ю.Ф. Исакова и А.А.Ворбьева и проф. Н.В.Белобородовой на диагностику воспалительных процессов и дисбиозов в клинической практике.
Суммарно метод в приложении к экологическим, биотехнологическим и клиническим проблемам изложен в докторской диссертации Г.А. Осипова (1996), пяти кандидатских диссертациях, статьях в отечественной и зарубежной периодике, пособиях для врачей. Часть материала представлена в Интернет на сайте Русского медицинского сервера www.rusmedserv.com/microbdiag на русском и www.rusmedserv.com/microbdiag/eng на английском языках.
Основы метода анализа микробных сообществ с использованием масс-спектрометрии
В основе метода микробной диагностики лежат многочисленные исследования последних двадцати лет отечественных и зарубежных ученых в области жирнокислотного состава микробной клетки и хемодифференциации микроорганизмов. Это труды C.W. Moss, E.Jantzen, D.B. Drucker, C.Asselineau, M.Goodfellow, D.E.Minnikin за рубежом З.П.Васюренко, Л.В.Андреева, В.И.Седова, С.Г.Батракова, Б.В.Розынова, Е.А.Киприановой и других в России и бывшем СССР.
Он развивался параллельно с исследованием экологических микробных сообществ по принципу специфики PLFA – фосфолипидных жирных кислот, корифеем в области которого является американский ученый из Университета штата Теннеси (Ноксвилл) D.C.White ([email protected]) и его последователи D.Ringelberg, P.D.Nichols. Однако в отличие от российских им не удалось разработать методику масштабного количественного видового анализа микробных сообществ в экологии и медицине по микробным маркерам и суммарным профилям жирных кислот.
Наболее близко к диагностике инфекционных заболеваний по маркерам подошел шведский ученый Lennart Larsson из Унивеситета Лунда ([email protected]), с которым мы в настоящее время сотрудничаем.
Итак, вернемся к кишечнику, то есть к населяющим его микроорганизмам. По современным представлениям они являются основными переработчиками потребляемой человеком пищи в молекулярную форму. Только в таком виде она может быть доставлена посредством всасывания на кишечной стенке в кровь и далее в клетки тела.
Кроме того, микробы синтезируют в своих клетках множество необходимых человеку веществ – витаминов, ферментов, незаменимых аминокислот и других. От стабильности этого процесса и зависит здоровье, следовательно — тонус и качество жизни человека. Как отмечалось, для контроля и управления микробиотой кишечника необходим количественный метод анализа ее состава, и он получен в виде опосредованного определения ее состава по данным масс-спектрометрии жирных кислот.
При использовании этого метода накоплена информация по пристеночной микрофлоре тощей, подвздошной и ободочной кишок путем ГХ-МС анализа микробных маркеров в биоптатах, получаемых в отделениии патологии тонкого кишечника ЦНИИГ, возглавляемом профессором Пафеновым А.И., при исследованиях здоровых добровольцев и больных с синдромом раздраженного кишечника и антибиотико-ассоциированной диареей.
Эти исследования впервые позволили установить характер распределения микроорганизмов по отделам кишечника. Их сопоставление с анализом фекалий у тех же пациентов показали, что адекватно динамике заболевания и лечения пробиотиками меняется только пристеночная микробиота. Микрофлора фекалий каких-либо корреляций с процессом не обнаруживает.
Нам удалось измерить концентрацию микробных компонентов непосредственно в месте обитания, где присутствуют сами клетки микробов кишечной стенки. Поэтому мы вправе делать прямые доступные нам сопоставления между концентрацией маркеров и числом микробных клеток в условиях отсутствия пищевой липидной компоненты, поскольку биоптаты получали натощак.
Такая логика убеждает нас в том, что мы измерили ведущую микрофлору кишечной стенки. Ведущую в количественном отношении, так как оказалось, что при наличии биоптата весом 4мг мы можем детектировать микроорганизмы начиная с концентрации 104 — 105 кл/г, поэтому, значительная часть микрофлоры осталась вне поля наших возможностей. Как оказалось, общая численность микроорганизмов кишечной стенки в норме имеет величину в пределах (0,5-1,3)х1011кл/г в зависимости от отдела кишечника.
Плотность заселения стенки кишечника в дистальном направлении меняется мало: в подвздошной кишке она в два раза меньше, а в толстой в полтора раза больше, чем в тощей. Измеренная нами пристеночная микрофлора оказалась существенно более концентрированной, чем просветная (по литературным данным [Schaechter, 1993]), которая в тонкой кишке на шесть а в подвздошной кишке на пять порядков ниже по численности (до 105 – 106 кл/мл соответственно), и только в ободочной кишке соответствует таковой в ее содержимом.
Видовой состав микроорганизмов соответствует известным представлениям о компонентах кишечной микрофлоры, в особенности – микроорганизмов фекалий [24]. Однако сходство ограничивается категориями общего характера: качественного состава и приоритетного (рангового) содержания основных элементов кишечного микробиоценоза. Действительно, в толстом кишечнике и фекалиях существенно больше анаэробов.
Полученная нами общая численность микроорганизмов для фекалий находится в пределах интервала значений 0,6-5´ 1011 кл/г, что согласуется с известными литературными данными измерений генетическим и культурально-биохимическим методами. Совпадает с известными оценками и относительное количество анаэробов в них, которое по нашим данным составляет 88%.
Родовое распределение трудно сравнивать с литературными данными, так как в них приводится очень широкий диапазон значений, — в пределах 3-6 порядков. Тем не менее, совпадает наша оценка о приоритете рода Eubacterium, численность которых имеет порядок 1011кл/г (109 – 1012 по литературным данным), о количестве бактероидов 1010 кл/г (1010 — 1012 по известным данным), клостридий — 6 х 1010 кл/г (105 — 1011 соответственно), бифидобактерий 1010кл/г (1010 — 1012), а также по энтерококкам, энтеробактериям, лактобациллам и стафилококкам.
Этот результат позволяет утверждать что анализ микробиоты фекалий методом ГХ-МС по жирным кислотам клеточной стенки микрорганизмов дает достоверные данные об их численности. Следовательно, можно считать так же достоверными приводимые здесь сведения о составе микроорганизмов в биоптатах кишечной стенки.
Результаты разных исследований микробиоты фекалий отводят бифидобактериям в их составе почти от 100% до 0,1% (табл. 1). Диапазон в три порядка вряд ли вызван тем, что люди разные, — в каждом исследовании приводится серьезная статистика и добросовестная аналитическая процедура. Разницу следует, скорее, отнести к особенностям сопоставляемых методов количественных измерений.
Не вдаваясь в детали, можно заключить, что эффект доминирования бифидобактерий создает рутинная практика анализа только бифидобактерий и условно-патогенной микрофлоры при исследованиях дисбактериозов. Как видно из поля зрения микробиолога при этом выпадают эубактерии, бактероиды и клостридии, которых в фекалиях по современным оценкам по крайней мере в несколько раз больше, чем бифидобактерий.
Это заблуждение выглядит естественным, если вспомнить, что в рамках общей микробиологии принято считать, что в микробном сообществе в среднем культивируемыми являются не более 20% микроорганизмов любого местообитания. Что касается фекалий, то по оценкам молекулярно-генетическими методами так же оказывается, что определение 60-80% их микробиоценоза не доступно для культуральных методов.
Данные масс-спектрометрии коррелируют с генетическими (в рамках сопоставимости микробиологических количественных измерений) и одинаково показывают, что эубактерий, бактероидов и клостридий вместе и по отдельности на порядок больше, чем бифидобактерий.
Применение масс-спектрометрического метода дало возможность измерить численность более 50 таксонов микроорганизмов кишечника не только в фекалиях, но и в отделах самого кишечника, путем анализа их маркеров (жирных кислот) непосредственно в биоптатах, полученных при интестиноскопии и колоноскопии с ретроградной илеоскопией.
Эти данные показывают, что там также доминируют эубактерии, а их видовой состав существенно меняется по длине кишечника.Следует отметить филогенетическое родство эубактерий и клостридий. В определителе Берджи 9-го издания прямо сказано, что родEubacterium создан для удобства, чтобы поместить в него слабо спорообразующие клостридии.
Таким образом, кишечная микробиота представляет собой доминирующий континуум штаммов и видов родовClostridium и Eubacterium при равновеликом суммарном количестве бактероидов, бифидобактерий и лактобацилл.
Приведенные данные свидетельствуют о важности рода Eubacterium в формировании и функционировании кишечной микробиоты. Теперь уже трудно, после проведенного анализа филогенетических связей, оторвать его от рода Clostridium (по крайней мере группы C.coccoides) и рассматривать их как пищеварительно важную группу пептолитических и целлюлолитических организмов. Следует отметить принципиально важную особенность представителей рода Eubacterium, заключающуюся в способности образовывать водород.
Это ключевое свойство консорциумов микроорганизмов, осуществляющих дайджест органического субстрата при анаэробных процессах в природе (болота), в рубце жвачных и в биотехнологии при анаэробном сбраживании разного рода отходов и получении биогаза. Мукозный слой кишечника человека по существу является аналогичным биореактором. Там идет образование метана, следовательно, работают архебактерии-метаногены, эффективность которых строго зависима от концентрации водорода в системе.
В метаногенном сообществе водородные бактерии играют ключевую регуляторную роль еще и благодаря обратной связи процесса продукции и потребления водорода на первичный процесс расщепления углеводов с образованием ацетата. При СРК, как следует из наших измерений, наибольшие изменения претерпевает численность эубактерий, что должно приводить к увеличению концентрации водорода в системе.
Действительно, ранее экспериментально показано четырехкратное увеличение концентрации водорода в выдыхаемом воздухе у больных с СРК (King, 1998) и его возвращение в норму при снятии симптомов в результате ограничительной диеты.
Основную долю (от 70% в тощей кишке до 90 в фекалиях) микроорганизмов во всех отделах кишечника составляют анаэробы. Второе место по численности в тощей кишке занимают аэробные актиномицеты – 17% (в фекалиях их всего 0,7 %). Аэробные кокки (стафилококки, стрептококки, энтерококки) и коринеформные бактерии) – составляют 5% колонизации тонкого кишечника по сравнению с 0,7 % в фекалиях. Доля энтеробактерий и энтерококков по отделам кишечника и в фекалиях близка к 2%.





